【実務詳解】新設「物品用消毒剤たる医薬部外品」参入ガイド
「除菌雑貨」から「消毒承認」へ。実務の壁をどう越えるか
2023年(令和5年)、消毒剤市場に新たな「王道」が開通しました。これまで医薬品か雑貨(除菌剤)としてしか販売できなかった物品用の消毒剤について、国が正式に「医薬部外品」として承認する制度を開始したのです。
しかし、この承認ルートは「申請すれば誰でも通る」ものではありません。厚生労働省の通知には、成分、濃度、効能範囲に関する極めて厳格な「3つのハードル」が設定されています。
本記事では、令和5年4月28日付の課長通知(薬生薬審発0428第1号)およびQ&A(令和5年5月8日付事務連絡)に基づき、開発・薬事担当者が押さえるべき承認要件のポイントを解説します。
BtoB市場を狙える「物品用の消毒剤たる医薬部外品」とは?
まず、この新カテゴリーの「守備範囲」を正確に把握しましょう。
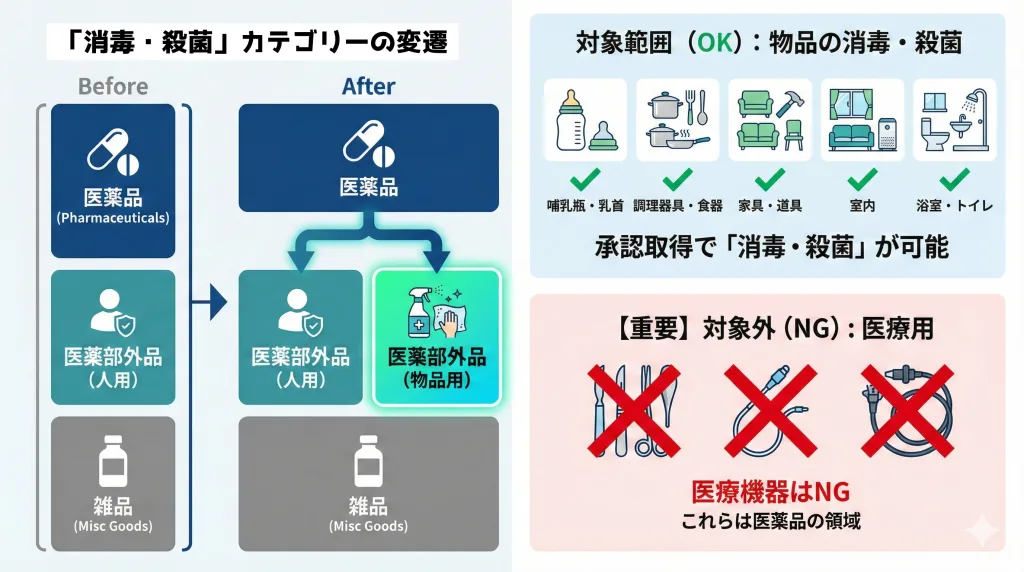
承認申請対象となる範囲
厚生労働省告示第181号により、医薬部外品の範囲に「物品の消毒・殺菌の用に供されることが目的とされているもの」が追加されました。
それについて承認申請対象となる範囲については、通知(薬生薬審発0428第1号)に示されています。
- 承認申請対象となる効能効果:以下の範囲内であること
- 家具・器具・物品等の消毒・殺菌
- 哺乳びん・乳首の消毒・殺菌
- 調理器具、食器の消毒・殺菌
- 室内の消毒・殺菌
- 浴室・便所の消毒・殺菌
- 用法・用量:一般用医薬品で承認を受けている範囲内
- 剤形:一般用医薬品で承認を受けている範囲内
これらは従来、雑貨として「除菌」「ウイルス除去」としか言えませんでしたが、承認を取得すれば「消毒」「殺菌」という強力な効能効果を標榜できます。
【重要】対象外となるもの(NG用途)
承認申請において最も注意すべきは「医療用」との混同です。
「医療に用いられる器具等の消毒・殺菌」は、本カテゴリーの対象外です。メス、カテーテル、内視鏡などの医療機器の消毒は、依然として「医薬品(医療用医薬品)」の領域であり、医薬部外品では認められません。パッケージデザインや広告において、手術室や医療器具を連想させる表現は医薬部外品としては不適当ですので「不承認」の要因となります。
承認取得の「3大要件」をクリアせよ
通知(薬生薬審発0428第1号)には、承認審査をパスするための具体的な要件が示されています。開発段階で以下の基準を満たしていなければ、申請は受理されません。
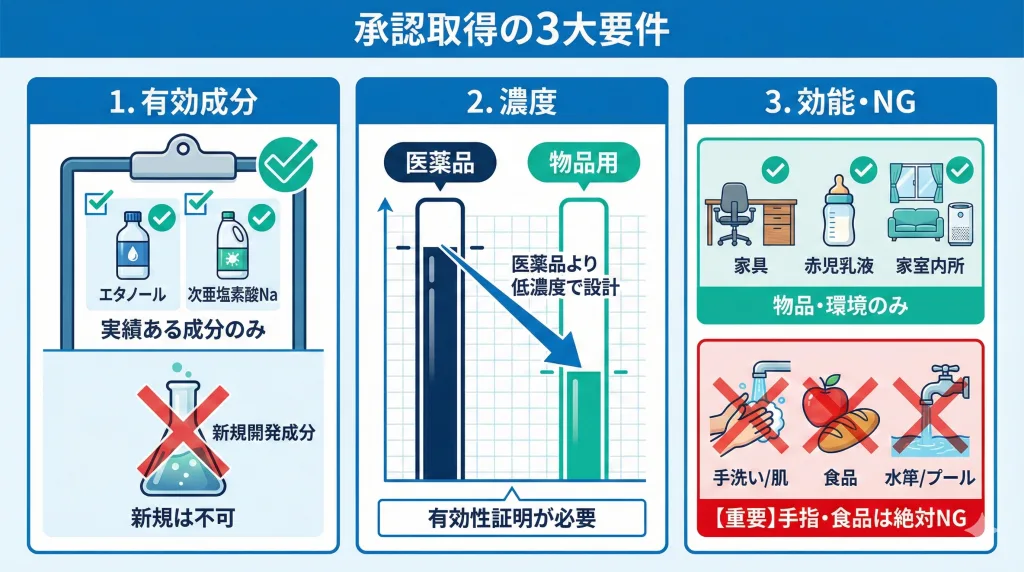
1. 【有効成分】「実績ある成分」に限る(新規成分は不可)
本カテゴリーで使用できる有効成分は、無制限ではありません。「令和4年10月4日時点で、物品等の消毒・殺菌を謳った一般用医薬品に配合実績のある有効成分」に限定されています。
- 使用可能な成分の例(Q&Aより):
- エタノール
- クロルヘキシジングルコン酸塩
- 次亜塩素酸ナトリウム
- ジクロルイソシアヌール酸ナトリウム
- ベンザルコニウム塩化物
- 亜塩素酸水
- (※ポビドンヨードなど、物品用としての実績が乏しいものは要確認)
「当社独自の新規開発成分」などは、このルートでは申請できないということですね。医薬品ルートとなります。
また、有効成分の複数組み合わせも認められないとされています。
2. 【濃度】医薬品より「低濃度」であること
ここが製品設計の肝です。医薬部外品は、その定義から、医薬品よりも人体への作用が緩和でなければなりません。そのため、以下のルールが課されています。
製造販売承認申請する際の有効成分の配合濃度は、……一般用医薬品に配合されている有効成分の製剤中配合濃度の最低濃度より低い濃度とすること。
- 意味すること:
- 例えば、消毒用エタノール(医薬品)の濃度が「76.9~81.4vol%」である場合、物品用医薬部外品はこれより低い濃度設定(例:70%台前半など)で設計し、かつその濃度で有効性(殺菌データ)を証明する必要があります。
- 希釈タイプの場合:
- 希釈後の使用時濃度が、上記の基準を満たす必要があります。
「濃ければ効くから良い」ではありません。「医薬品未満の濃度で、しっかり効く」という絶妙な配合バランスが求められます。
3. 【効能】表現の限界
承認申請時に設定できる効能・効果の文言も定型化されています。「家具・器具・物品等の消毒・殺菌」「哺乳びん・乳首の消毒・殺菌」「室内の消毒・殺菌」などの範囲内に留める必要があります。
NGポイント1:用途の拡張はできない
「手指」や「皮膚」への適用を匂わせる表現は一切認められません。Q&Aでは、食べ物、水、プール水、おむつ、排せつ物、嘔吐物についても認められないとされています。
NGポイント2:有効成分の使用前例と用途の対応が必要
そのため、申請時には申請品目の効能・効果及び用法・用量の根拠となる対物用医薬品の前例を提示することが求められています(医療用医薬品は前例とすることはできません)。
申請実務のポイントとロードマップ
申請区分は「殺虫剤等」扱い
ここが実務上のトリッキーな点です。物品用消毒剤は、人体に直接使用しないため、審査区分上は「殺虫剤(防除用医薬部外品)」に準じた扱いとなります。したがって、申請手数料や添付資料(モックアップ等の要件)も、防除用医薬部外品のルールを参照することになります。
提出先と審査期間
- 提出先: 厚生労働大臣(実務はPMDA:医薬品医療機器総合機構)
- 審査: 都道府県知事承認ではなく、大臣承認品目です。よってPMDAによる審査が行われます。安定性試験(加速試験等)や薬理試験(殺菌効力試験)のデータ取得には、相応の時間(半年~1年以上)とコストを見込む必要があります。
「指定医薬部外品」ではない?
本カテゴリーは、コンビニ販売等を目的とした「指定医薬部外品(規制緩和品目)」とは法的な位置づけが異なります 。 しかし、消費者への情報提供の観点から、容器への成分分量表示等は行うことが「望ましい」と指導されています。
あと、対物用消毒剤たる医薬部外品はGMP適用の対象外です。
よくある質問(Q&A)
雑貨(除菌剤)のまま販売してはいけませんか?
違法ではありませんが、「消毒」「殺菌」とは言えません。あくまで「除菌」「清浄」等の表現に留める必要があります。また、2024年の特例廃止以降、雑貨品に対する広告監視は厳しくなっており、「事実上の消毒効果」を暗示する広告は摘発リスクが高まっています。
既に海外で販売している製品を輸入できますか?
成分と濃度が日本の基準に合致していれば可能です。 ただし、海外データ(外国外国製造業者認定など)に加え、日本の試験法に基づいた品質試験データが必要になるケースが多いため、事前のギャップ分析が不可欠です。
[まとめ] 開発段階からの「戦略的設計」がカギ
新設された「物品用医薬部外品」は、ブルーオーシャンへのパスポートです。しかし、その取得には「医薬品の最低濃度未満」という、非常に狭いストライクゾーンを狙った製品設計(処方開発)が必要です。
「申請書を書いて終わり」ではありません。当事務所では、製品開発の初期段階から参画し、「この成分・濃度で承認は取れるか?」「どのような試験データが必要か」といった開発薬事コンサルティングを提供しています。
確実な承認取得を目指すメーカー様は、試作段階からご相談ください。
お気軽にご相談ください。
- 初回相談は無料です。
- 行政書士には秘密保持の義務が課せられております。
- フォームに入力されたメールアドレス以外に、当事務所から連絡差し上げることはいたしません。