【医療機器ポイント解説】事業の成否を分ける「医療機器のクラス分類」とは?

【医療機器ポイント解説】事業の成否を分ける「医療機器のクラス分類」とは?
はじめに
自社で開発した製品や、海外で見つけた新しいサービス。それを日本国内で「医療機器」として流通させるには、どのような規制が関わってくるのでしょうか。医療機器ビジネスへの新規参入を考えるとき、最初に理解すべき最も重要な概念の一つが「クラス分類」です。また、すでに事業を行っている企業の薬事担当者の方にとっても、クラス分類の正確な理解は、新製品開発や事業範囲の拡大を検討する上で、全ての土台となる知識です。
本記事では、医療機器のクラス分類の基本から、分類によって事業に何が求められるのか、そして特殊なケースまでを分かりやすく解説します。
1. なぜ医療機器はクラス分類されるのか?
結論から言うと、その目的は**「人体へのリスクに応じた適切な規制を行うため」**と言えるでしょう。
医療機器は、人の疾病の診断、治療、予防に使用されたり、身体の構造や機能に影響を及ぼしたりするものです。万が一、不具合が生じた場合、人体に与える影響、すなわちリスクには、かすり傷程度で済むものから、生命に直接関わるものまで、非常に大きな幅があります。
そこで国は、すべての医療機器を同じ基準で規制するのではなく、リスクの大小に応じて4つのクラスに分類し、それぞれに合った規制を課しています。リスクが低いものは手続きを簡素化して迅速な市場投入を促し、リスクが高いものは厳格に審査・管理することで国民の安全を確保する。この合理的な仕組みが、医療機器規制の根幹をなしています。

こちらの記事も読まれています:
(<u>こちらの記事も読まれています:[医療機器?福祉用具?それとも?事業戦略上の重要な選択]</u>)
2. 4つのクラス分類を具体的に理解する
医療機器は、薬機法(医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律)に基づき、以下の4つに分類されます。クラスの数字が大きくなるほど、人体へのリスクは高くなります。
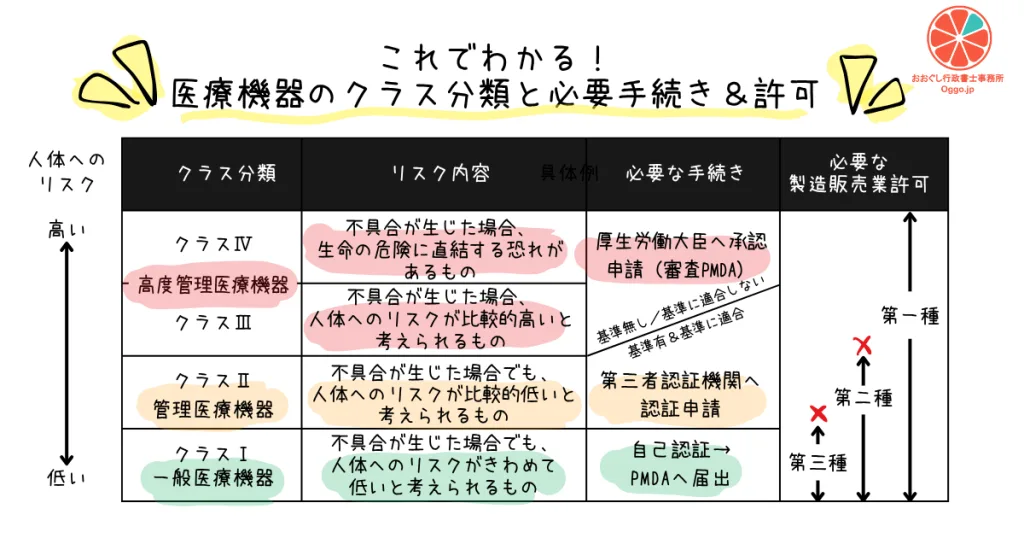
クラスⅣ:高度管理医療機器
- リスクの程度: 患者への侵襲性が高く、不具合が生じた場合、生命の危険に直結するおそれがあるもの。
- 規制: クラスⅢと同様、国(PMDA審査)による「承認」が必要です。
- 具体例: ペースメーカー、人工心臓弁、冠動脈ステントなど
クラスⅢ:高度管理医療機器
- リスクの程度: 不具合が生じた場合、生命や健康に重大な影響を与えるおそれがあるもの。
- 規制: 国(PMDA審査)による「承認」が必要です。
- 具体例: 視力補正用コンタクトレンズ、人工呼吸器、透析器、人工骨、歯科用インプラントなど
クラスⅡ:管理医療機器
- リスクの程度: 不具合が生じた場合でも、人体へのリスクが比較的低いと考えられるもの。
- 規制: 原則として、国が登録した第三者認証機関(Registered Certification Body)による「認証」が必要です。ただし、認証基準がない一部の医療機器については、国による「承認」が必要となります。
- 具体例: 電子体温計、家庭用マッサージ器、家庭用電気治療器、MRI装置、内視鏡など
クラスⅠ:一般医療機器
- リスクの程度: 不具合が生じた場合でも、人体へのリスクが極めて低いと考えられるもの。
- 規制: 製造販売にあたり、PMDA(独立行政法人 医薬品医療機器総合機構)への「届出」が必要です。国による承認や第三者機関による認証は不要です。
- 具体例: メス、ピンセット、X線フィルム、聴診器など
3. クラス分類によって、事業者に求められる体制はどう変わるか
医療機器のクラス分類と規制の概要
| 分類 | 名称 | 人体へのリスクの程度 | 規制(製造販売) | 必要な業許可(製造販売業) | 販売・貸与における規制 |
| クラスⅠ | 一般医療機器 | 不具合が生じた場合でも、人体へのリスクが極めて低いと考えられるもの | PMDAへの届出 | 第三種医療機器製造販売業許可 | - |
| クラスⅡ | 管理医療機器 | 不具合が生じた場合でも、人体へのリスクが比較的低いと考えられるもの | 第三者認証機関による認証 (一部は国による承認) | 第二種医療機器製造販売業許可 | 特定保守管理医療機器は営業所ごとに許可が必要 |
| クラスⅢ | 高度管理医療機器 | 不具合が生じた場合、生命や健康に重大な影響を与えるおそれがあるもの | 国(PMDA審査)による承認 | 第一種医療機器製造販売業許可 | 営業所ごとに許可が必要 |
| クラスⅣ | 高度管理医療機器 | 患者への侵襲性が高く、不具合が生じた場合、生命の危険に直結するおそれがあるもの | 国(PMDA審査)による承認 | 第一種医療機器製造販売業許可 | 営業所ごとに許可が必要 |
このクラス分類は、製品を市場に出すための手続きだけでなく、事業を行うために必要な会社の「許可」や「体制」にも直結します。
- 必要な「業許可」の違い:クラスⅡ以上の医療機器の製造販売を行うには、都道府県知事から「第二種医療機器製造販売業許可」以上(クラスⅢ・Ⅳは第一種)の取得が必須です。一方、クラスⅠのみであれば、より要件の緩やかな「第三種医療機器製造販売業許可」で足ります。
- 品質管理(QMS)・安全管理(GVP)の基準の違い: 医療機器の品質を管理する体制(QMS)や、市販後の安全性を管理する体制(GVP)の構築が求められます。クラス分類が上がるほど、より厳格な管理体制の構築と運用が必要です。
- 販売・貸与における規制の違い: クラスⅢ、Ⅳの高度管理医療機器や、保守点検が必要な特定保守管理医療機器を販売・貸与するには、営業所ごとに「販売業・貸与業の許可」が別途必要になります。
発展編:少し特殊な医療機器
一般的な医療機器のほかに、以下のような特殊なケースも存在します。
- コンビネーション医療機器 医療機器と医薬品・医薬部外品が一体的に組み合わされた製品です。薬剤が塗布されたステントや、薬液が充填された注射器などが該当します。医療機器と医薬品、両方の規制を考慮した、より複雑な承認申請プロセスが必要となります。
- 組合せ医療機器(キット製品) 複数の医療機器などを、特定の医療目的のために一つの製品として組み合わせたものです。手術用の器具一式をパッケージにしたサージカルキットなどが代表例です。個々の構成品が医療機器として承認などを得ていることが前提となります。
まとめ:自社製品のクラス分類を調べ、事業計画を具体化しよう
製品アイデアを具体的なビジネスプランに落とし込むためには、まずその製品がどのクラスに該当する可能性が高いのかを見極めることが不可欠と言えるでしょう。クラス分類によって、必要な許可、構築すべき管理体制、そして製品を市場に出すまでの時間やコストが大きく変わってくるからです。
当事務所では、貴社の製品アイデアがどのクラスに該当するかの判断から、事業計画に応じた最適な許認可取得のロードマップ作成、そしてQMS/GVP体制の構築まで、ワンストップでサポートします。医療機器ビジネスの第一歩を、専門家と共に踏み出しませんか。
お気軽にご相談ください。
- 初回相談は無料です。
- 行政書士には秘密保持の義務が課せられております。
- フォームに入力されたメールアドレス以外に、当事務所から連絡差し上げることはいたしません。
