【医療機器ポイント解説】そのアプリ、医療機器かも?プログラム医療機器(SaMD)解説
はじめに
自社で開発した健康管理アプリや、AIを用いた画像診断支援ソフトウェア。それらが、薬機法(医薬品医療機器等法)上の「医療機器」として規制の対象になる可能性があることをご存じでしょうか。近年、このような「プログラム医療機器(SaMD: Software as a Medical Device)」の市場が世界的に拡大しており、多くのIT企業が新規参入を目指しています。
本記事では、このSaMDとは何か、そして事業化する上で避けて通れない承認・認証のポイントを解説します。
1. 「プログラム医療機器」と「医療機器プログラム」
薬機法には、「プログラム医療機器」と「医療機器プログラム」という、非常によく似た二つの言葉が登場します。まずはこの定義の違いを理解することが第一歩です。
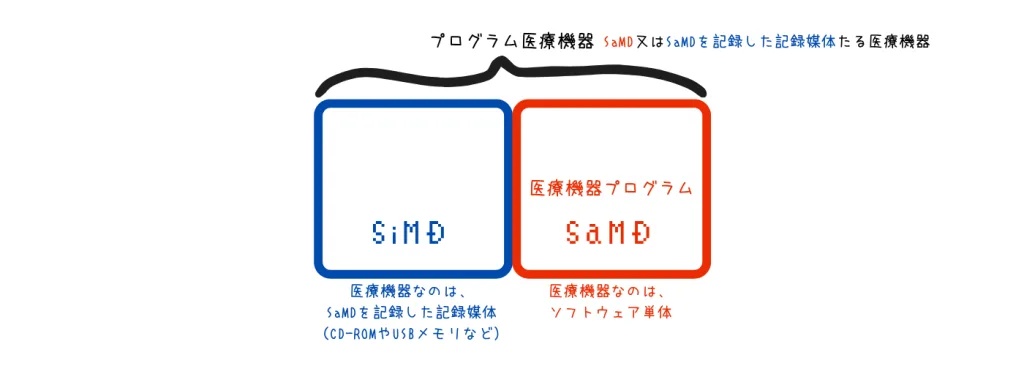
- ① 医療機器プログラム = SaMDの本質
薬機法第2条第13項では、「人若しくは動物の疾病の診断、治療若しくは予防に使用されること、又は人若しくは動物の身体の構造若しくは機能に影響を及すことが目的とされているプログラム」と定義されています。 これが「SaMD(Software as a Medical Device)」の法的な定義そのものであり、ソフトウェア単体で医療機器としての機能を持つものを指します。 - ② プログラム医療機器 = SaMD又はSaMDを記録した”モノ”
薬事法施行規則第1条第3項では、「医療機器プログラム又はこれを記録した記録媒体たる医療機器」と定義されています。 つまりプログラム医療機器=「SaMD又はSiMD(Software in a Medical Device)」ということです。ここでSiMDとは「医療機器プログラム」をCD-ROMやUSBメモリなどに記録した、”モノ”としての医療機器を指す言葉です。
…ややこしいですよね。私も何度覚えてもどっちだっけ?となります。 結構みなさんSaMD(サムディー)と呼ぶことが多く、結果取り違えも減るので、私も「SaMD」、「SaMDではない、SiMD(シムディー)の方」と言ったりしますね。
FDAでは医療機器にかかるソフトウェアについては、以下の3つに分けられるとしており、asとinの言葉がイメージさせるものは全然違うのでややこしくなくていいなーと思ってます。
- Software as a Medical Device
- Software in a Medical Device
- Software used in the manufacture or maintenance of a Medical Device
2. 「医療機器プログラム」に該当するかの判断基準
自社のソフトウェアが規制対象になるか否か。PMDAが示す考え方に基づき、判断のステップを解説します。
- 大原則:プログラムの「目的」で判断される 最も重要なのは、ソフトウェアの機能や技術の高度さではなく、そのプログラムが「疾病の診断、治療、予防」などを目的としているかどうかです。
- 判断フロー①:そもそも医療機器の定義に当てはまるか? プログラムが、人の特定の病状や健康状態を評価し、具体的な診断や治療方針の示唆を行うなど、医療的な判断に直接介入する目的を持っているかが問われます。
- 該当する例:
- 撮影した医用画像から病変の候補を検出する
- 心電図波形を解析して不整脈の種類を特定する
- 該当しない例:
- 病院の予約システム、電子カルテの閲覧ソフト
- 健康管理のための記録・グラフ化(歩数、体重、食事など)
- 医学書のデータベース
- 該当する例:

こちらの記事も合わせてお読みください。自社製品をあえて「医療機器」にしない戦略も含め、ヘルスケア市場への3つの参入ルートと成功戦略を比較検討したい方向け。
- 判断フロー②:ソフトウェアとして提供されるものか? ハードウェアの医療機器を動かすためだけの、それと一体不可分のソフトウェア(組み込みソフトウェア)は、SaMDではなく、ハードウェアの一部(SiMD)として規制されます。SaMDは、スマートフォンやPC、サーバー上で動作し、ソフトウェア単体で医療機器としての価値を提供するものが対象です。
- 判断フロー③:機能の変更を意図しているか? 医療機器の保守点検のために一時的に使用するプログラムや、単にデータを保管・転送するだけの機能を持つプログラムは、原則としてSaMDには該当しません。
3. 通常の医療機器との違い - 開発プロセスにおける注意点
SaMDの開発には、一般的なソフトウェア開発とは異なる、薬機法特有のルールが求められます。
- ソフトウェア特有の「ライフサイクルプロセス」 SaMDは、開発して終わりではなく、発売後のバージョンアップやバグ修正、セキュリティパッチの適用といった継続的なメンテナンスが不可欠です。薬機法では、この開発から設計変更、廃棄に至るまでの一貫した管理プロセス(ライフサイクルプロセス)を構築し、文書化することが求められます。これは、医療機器ソフトウェアのライフサイクルプロセスの国際規格である「IEC 62304」に準拠しています。
- サイバーセキュリティ対策の重要性 ネットワークに接続されることを前提とするSaMDでは、開発の初期段階から、情報漏洩や不正アクセスを防ぐためのサイバーセキュリティ対策を設計に組み込むことが必須要件となっています。
4. SaMDの承認・認証申請ロードマップ
- ステップ①:該当性確認とクラス分類 まず、自社のソフトウェアがSaMDに該当するかを行政や専門家と相談し、確認します。その後、リスクに応じてクラス分類(Ⅰ〜Ⅳ)を特定します。
- ステップ②:開発プロセスの構築 上記のライフサイクルプロセスに沿った開発体制を構築し、全ての工程を文書化(仕様書、テスト記録など)します。
- ステップ③:臨床評価の実施 ソフトウェアであっても、その有効性・安全性を証明するための臨床的な評価(臨床試験データや既存の論文の活用など)が必要となります。
- ステップ④:承認・認証申請 クラス分類に応じた申請先に、サイバーセキュリティに関する資料など、SaMD特有の添付資料と共に申請を行います。
5. SaMD特有の新しい審査制度「IDATEN」
AIを活用したSaMDなどは、発売後もデータ学習によって性能が向上していく特性があります。しかし、従来の制度では、少しの改良でも時間のかかる「一部変更承認」が必要でした。 この課題を解決するのが、IDATEN(Improvement Design within Approval for Timely Evaluation and Notice)という新しい制度です。 これは、事前に変更計画の範囲を承認審査時に示しておくことで、その範囲内での改良であれば、事前の承認を不要とし、事後の届出で済むようにした画期的な仕組みです。これにより、ソフトウェアの迅速な性能向上が可能になります。
6. 承認後のステップ:保険適用について
薬機法上の承認・認証を得て製品を市場に出せる段階になっても、もう一つ重要なステップがあります。それが「保険適用」です。
- 保険適用とは? 開発したSaMDが、公的医療保険の対象となり、医療機関が患者に使用した際に診療報酬として請求できるようになるための手続きです。これがなければ、原則として自由診療(全額自己負担)でしか使えません。
- 承認とは別の手続き 薬機法に基づく承認・認証は「市場に出すための安全性・有効性の確認」ですが、保険適用は「保険診療で使うための価格や評価を決める」手続きであり、全く別のプロセスです。厚生労働省(中医協)に対して専門的な申請やヒアリングが必要となります。
- 今後の展望 保険適用のプロセスもまた専門的な知識を要します。これについては、今後のポイント解説記事で詳しく取り上げる予定です。
まとめ:早期の規制理解が、事業の否を分ける
プログラム医療機器(SaMD)は、大きなビジネスチャンスを秘めていますが、同時に薬機法という特殊な規制を理解することが不可欠です。一般的なアプリ開発の感覚で進めてしまうと、後から大幅な手戻りが発生する可能性があります。企画・設計の早い段階から規制の専門家を交え、適切な開発プロセスを構築することが、スムーズな事業化の鍵となります。貴社のソフトウェアがプログラム医療機器に該当するか、どのような手続きが必要か、お気軽にご相談ください。
お気軽にご相談ください。
- 初回相談は無料です。
- 行政書士には秘密保持の義務が課せられております。
- フォームに入力されたメールアドレス以外に、当事務所から連絡差し上げることはいたしません。
